При рассмотрении вопроса о скорости реакции необходимо различать реакции, протекающие в гомогенной системе (гомогенные реакции), и реакции, протекающие в гетерогенной системе (гетерогенные реакции).
Системой в химии принято называть рассматриваемое вещество или совокупность веществ. При этом системе противопоставляется внешняя среда — вещества, окружающие систему. Обычно система отграничена от среды.
Различают гомогенные и гетерогенные системы. Гомогенной называется система, состоящая из одной фазы. Гетерогенной — система, состоящая из нескольких фаз. Фазой называется часть системы, отделенная от других ее частей поверхностью раздела, при переходе через которую свойства системы изменяются скачком.
Примером гомогенной системы может служить любая газовая смесь (все газы при не очень высоких давлениях неограниченно растворяются друг в друге), хотя бы смесь азота с кислородом. Другим примером гомогенной системы может служить раствор хлорида натрия, сульфата магния, азота и кислорода в воде. В каждом из этих двух случаев система состоит только из одной фазы: из газовой фазы в первом примере и из водного раствора во втором.
Если реакция протекает в гомогенной системе, то она идет во всем объеме этой системы. Например, при сливании (и перемешивании) растворов серной кислоты и тиосульфата натрия помутнение, вызываемое появлением серы, наблюдается во всем объеме раствора:
Если реакция протекает между веществами, образующими гетерогенную систему, то она может идти только на поверхности
раздела фаз, образующих систему. Например, растворение металла в кислоте:
может протекать только на поверхности металла, потому что только здесь соприкасаются друг с другом оба реагирующих вещества. В связи с этим4скорость гомогенной реакции и скорость гетерогенной реакции определяются различно,

Величину поверхности твердого тела не всегда легко измерить. Поэтому иногда скорость гетерогенной реакции относят не к единице поверхности, а к единице массы или объема твердой фазы.
Оба этих определения можно записать в математической форме. Введем обозначения: vгомог — скорость реакции в гомогенной системе; vгетерог — скорость реакции в гетерогенной системе; n — число молей какого-либо из получающихся при реакции веществ; V — объем системы; t — время; S -— площадь поверхности фазы, на которой протекает реакция; D — знак приращения (Dn= n2-n1; D = t2-t1). Тогда: vгомог=Dn/(SDt).
Первое из этих уравнений можно упростить. Отношение числа молей (n) вещества к объему (V) системы представляет собою мольно-объемную концентрацию (С) данного вещества:
Последнее уравнение является математическим выражением другого определения скорости реакции в гомогенной системе: скоростью реакции в гомогенной системе называется изменение концентрации какого-либо из веществ, вступающих в реакцию или образующихся при реакции, происходящее в единицу времени.
Как уже говорилось, при практическом использовании химических реакций весьма важно знать, с какой скоростью будет протекать данная реакция в тех или иных условиях и как нужно изменить эти условия для того, чтобы реакция протекала с требуемой скоростью.
Скорость химической реакции зависит от природы реагирующих веществ и условий протекания реакции, важнейшими из которых являются следующие: концентрация с, температура t, присутствие катализаторов, а также от некоторых других факторов (например, от давления — для газовых реакций, от интенсивности движения жидкости или газа около поверхности, на которой происходит реакция, от измельчения — для твердых веществ, от радиоактивного излучения).
Влияние концентрации реагирующих веществ, Чтобы осуществилось химическое взаимодействие веществ А и В, их молекулы (частицы) должны столкнуться. Чем больше столкновений, тем быстрее протекает реакция. Число же столкновений тем больше, чем выше концентрация реагирующих веществ. Отсюда на основе обширного экспериментального материала сформулирован основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентрации реагирующих веществ:
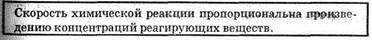
A+B=C+D этот закон выразится уравнением:
где сA и сB — концентрации веществ А и В, моль/л; k — коэффициент пропорциональности, называемый константой скорости Реакции. Основной закон химической кинетики называют законом действующих масс.
Из уравнения (12.1) нетрудно установить физический смысл константы скорости k: она численно равна скорости реакции, когда концентрация каждого из реагирующих веществ составляет 1 моль/л или когда их произведение равно единице.
Константа скорости реакции k зависит от природы реагирующих веществ и от температуры, но не зависит от их концентрации.
Уравнение (12.1), связывающее скорость реакции с концентрацией реагирующих веществ, называется кинетическим уравнением реакции. Если опытным путем определено кинетическое уравнение реакции, то с его помощью можно вычислить скорости при других концентрациях тех же реагирующих веществ.
Основной закон химической кинетики не учитывает реагирующие вещества, находящиеся в твердом состоянии, ибо их концентрации постоянны и они реагируют лишь на поверхности. Так, например, для реакции горения угля:
С+O2=СО2 кинетическое уравнение реакции имеет вид:
где k — константа скорости, сC — концентрация твердого вещества; S — площадь поверхности. Это величины постоянные. Обозначив произведение постоянных величин через k’, получим v=k’cO2, т.е. скорость реакции пропорциональна только концентрации кислорода.
Влияние температуры. Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа:

Математически эта зависимость выражается соотношением;
и конечной (t2) температурах, а g — температурный коэффициент скорости реакции, который показывает, во сколько раз увеличивается скорость реакции с повышением температуры реагирующих веществ на 10°.
Правило Вант-Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции. Температура влияет на скорость химической реакции, увеличивая константу скорости.
Энергия активации
Сильное изменение скорости реакции с изменением температуры объясняется тем, что в химическое взаимодействие вступают только активные молекулы (частицы), обладающие энергией, достаточной для осуществления данной реакции. Неактивные частицы можно сделать активными, если сообщить им необходимую дополнительную энергию, — этот процесс называется активацией. Один из способов активации — увеличение температуры: при повышении температуры число активных частиц сильно возрастает, благодаря чему резко увеличивается скорость реакции.

Ее определяют опытным путем, обозначают буквой Eа и обычно выражают в кДж/моль. Так, например, для соединения водорода с иодом (Н2+I2=2HI) Еa=167,4 кДж/моль, а для распада иодоводорода (2HI = Н2 +I2) Еa=186,2 кДж/моль.
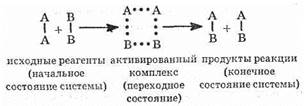
Энергия активации Ea зависит от природы реагирующих веществ и служит характеристикой каждой реакции. Эти представления поясняются рис. 17 на примере реакции в общем виде А2+В2=2АВ. Ось ординат характеризует потенциальную энергию системы, ось абсцисс — ход реакции: исходное состояние ® переходное состояние ® конечное состояние. Чтобы реагирующие вещества А2 и В2 образовали продукт реакции АВ, они должны преодолеть энергетический барьер С(рис. 17). На это затрачивается энергия активации Ea, на значение которой возрастает энергия системы. При этом в ходе реакции из частиц реагирующих веществ образуется промежуточная неустойчивая группи-

ровка, называемая переходным состоянием или активированным комплексом (в точке С), последующий распад которой приводит к образовании) конечного продукта АВ. Механизм реакции можно изобразить схемой:
Если при распаде активированного комплекса выделяется больше энергии, чем это необходимо для активации частиц, то реакция экзотермическая. Примером эндотермической реакции служит обратный процесс — образование из вещества АВ веществ А2 и В2: 2АВ= А2+В2. В этом случае процесс протекает также через образование активного комплекса A2B2, однако энергия активации больше, чем для прямого процесса: Е’а=Еа+DH (DН — тепловой эффект реакции). Для протекания эндотермических реакций требуется подвод энергии извне.
Как видно из рис. 17, разность энергий конечного состояния , системы (Hкон) и начального (Hнач) равна тепловому эффекту реакции:
Скорость реакции непосредственно зависит от значения энергии активации: если оно мало, то за определенное время протекания реакции энергетический барьер преодолевает большое число частиц и скорость реакции будет высокой, но если энергия активации велика, то реакция идет медленно.
При взаимодействии ионов энергия активации очень мала и ионные реакции протекают с очень большой скоростью (практически мгновенно).
Дата добавления: 2016-01-03 ; просмотров: 5554 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ

- 10 – 11 классы
- Химия
- 5 баллов
что такое гомогенная и гетерогенная реакция?
- Попроси больше объяснений
- Следить
- Отметить нарушение
Ninooo 05.12.2012
Что ты хочешь узнать?
Ответ
Проверено экспертом
ГОМОГЕННЫЕ РЕАКЦИИ , хим. р-ции, протекающие полностью в одной фазе. Примеры гомогенных реакций в газовой фазе: термич. разложение оксида азота 2N 2 O 5 -> 4NO 2 + О 2 ; хлорирование метана СН 4 + С1 2 -> СН 3 С1 + НС1; горение этана 2С 2 Н б + 7О 2 -> 4СО 2 + 6Н 2 О; образование озона в земной атмосфере ЗО 2 -> 2О 3 . В жидкой фазе гомогенно протекают разнообразные гомолитич. р-ции распада молекул на радикалы, нуклеоф. и электроф. замещения, отщепления, перегруппировки, а также цепные р-ции ( галоидирование , окисление , полимеризация ). Скорость простой гомогенной реакции при постоянном объеме подчиняется действующих масс закону . Гомогенные реакции между реагентами , первоначально находящимися в разных фазах, возможны при условии, что диффузия реагентов в ту фазу, где идет р-ция, много быстрее самой р-ции. При относительно медленной диффузии реагентов и быстром хим. взаимод. р-ция протекает на границе раздела фаз
ГЕТЕРОГЕННЫЕ РЕАКЦИИ , хим. р-ции с участием в-в, находящихся в разл. фазах и составляющих в совокупности гетерог. систему. Типичные гетерогенные реакции : термич. разложение солей с образованием газообразных и твердых продуктов (напр., СаСО 3 -> СаО + СО 2 ), восстановление ожсидов металлов водородом или углеродом (напр., РЬО + С -> Рb + СО), растворение металлов в к-тах (напр., Zn + + H 2 SO 4 -> ZnSO 4 + Н 2 ), взаимод. твердых реагентов (А1 2 О 3 + NiO -> NiAl 2 O 4 ). В особый класс выделяют гетерогенно-каталитич. р-ции, протекающие на пов-сти катализатора ; при этом реагенты и продукты могут и не находиться в разных фазах. Напр., при р-ции N 2 + + ЗН 2 -> 2NH 3 , протекающей на пов-сти железного кат., реагенты и продукт р-ции находятся в газовой фазе и образуют гомог. систему.
Системой в химии принято называть рассматриваемое вещество или совокупность веществ. Трудно представить существование абсолютно однородной системы, такой, чтобы состав и свойства любой, самой маленькой, ее части были бы одинаковы в любом месте. И тем не менее в химии очень часто говорят о гомогенных, т. е. однородных, системах. Чистые жидкости, газы и их смеси, растворы да и некоторые твердые вещества считаются гомогенными. Бетонный раствор, например, однороден с точки зрения строителя, но неоднороден для химика. Чистая вода гомогенна для химика, но неоднородна для физика-теоретика.
Где же рубеж? В химии разнородной, т. е. гетерогенной, называют такую систему, которая состоит из различных по физическим или химическим свойствам фаз, отделенных друг от друга поверхностями, на которых скачкообразно меняется одно или несколько свойств системы (состав, плотность, электропроводность и т. д.). Если таких поверхностей раздела нет — система считается однородной, гомогенной.
Простейшие примеры гетерогенных систем — вода с находящимся над ней паром, насыщенный раствор с осадком и т. д.
Если реакция протекает в гомогенной системе, то она идет во всем объеме этой системы. Если реакция происходит между веществами, образующими гетерогенную систему, то она может идти только на поверхности раздела фаз. Например, растворение металла в кислоте протекает лишь на поверхности металла, потому что только здесь соприкасаются друг с другом оба реагирующих вещества.
К самым сложным системам, пожалуй, следует отнести те, где подчас нельзя точно установить, гомогенные они или гетерогенные, – коллоидные растворы (см. Коллоидная химия), жидкие кристаллы, частично упорядоченные полимеры, полупроводники и т. д.
“>


Гомогенный — это когда все части одинаковые, а гетерогенный — когда разные. Например, молоко гомогенное, а салат гетерогенный. Это важно понимать, чтобы правильно описывать материалы и смеси.