С электропроводностью растворов солей в воде (электролитов) связано очень многое в нашей жизни. С первого удара сердца («живое» электричество в теле человека, на 80% состоящем из воды) до автомобилей на улице, плееров и мобильных телефонов (неотъемлимой частью этих устройств являются «батарейки» – электрохимические элменты питания и различные аккумуляторы – от свинцово-кислотных в автомобилях до литий-полимерных в самых дорогих мобильных телефонах). В огромных, дымящихся ядовитыми парами чанах из расплавленного при огромной температуре боксита электролизом получают алюминий – «крылатый» металл для самолётов и банок для «Фанты». Все вокруг – от хромированной решетки радиатора иномарки до посеребрённой серёжки в ухе когда-либо сталкивалось с раствором или расплавом солей, а следовательно и с электротоком в жидкостях. Не зря это явление изучает целая наука – электрохимия. Но нас сейчас больше интересуют физические основы этого явления.
Электроток в растворе. Электролиты
Из уроков физики в 8 классе нам известно, что заряд в проводниках (металлах) переносят отрицательно заряженные электроны.
Упорядоченное движение заряженных частиц называется электрическим током.
Но если мы соберем прибор (с электродами из графита):
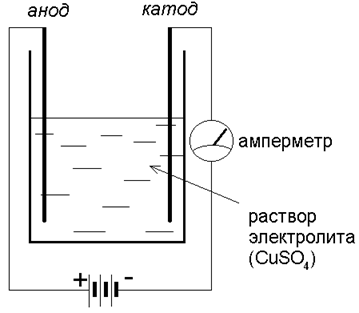
то убедимся, что стрелка амперметра отклоняется – через раствор идет ток! Какие же заряженные частицы есть в растворе?
Ещё в 1877 году шведский ученый Сванте Аррениус, изучая электропроводность растворов различных веществ, пришел к выводу, что её причиной являются ионы, которые образуются при растворении соли в воде. При растворении в воде молекула CuSO4 распадается (диссоциирует) на два разнозаряженных иона – Cu2+ и SO42- . Упрощенно происходящие процессы можно отразить следующей формулой:
ü Проводят электрический ток растворы солей, щелочей, кислот.
ü Вещества, растворы которых проводят электрический ток, называются электролитами.
ü Растворы сахара, спирта, глюкозы и некоторых других веществ не проводят электрический ток.
ü Вещества, растворы которых не проводят электрический ток, называются неэлектролитами.
Процесс распада электролита на ионы называется электролитической диссоциацией.
С. Аррениус, который придерживался физической теории растворов, не учитывал взаимодействия электролита с водой и считал, что в растворах находятся свободные ионы. В отличие от него русские химики И. А. Каблуков и В. А. Кистяковский применили к объяснению электролитической диссоциации химическую теорию Д. И. Менделеева и доказали, что при растворении электролита происходит химическое взаимодействие растворённого вещества с водой, которое приводит к образованию гидратов, а затем они диссоциируют на ионы. Они считали, что в растворах находятся не свободные, не «голые» ионы, а гидратированные, то есть «одетые в шубку» из молекул воды. Следовательно, диссоциация молекул электролитов происходит в следующей последовательности:
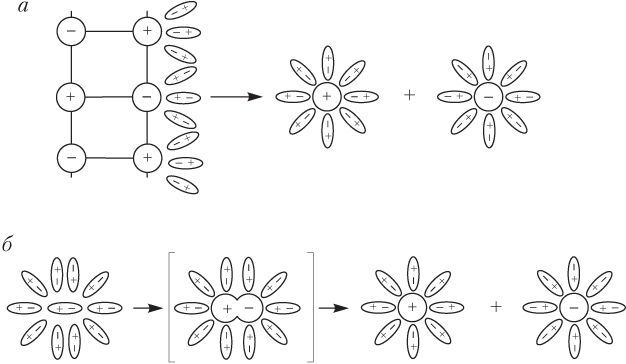
а) ориентация молекул воды вокруг полюсов молекулы электролита
б) гидратация молекулы электролита
г) распад её на гидратированные ионы
По отношению к степени электролитической диссоциации электролиты делятся на сильные и слабые.
ü Сильные электролиты – такие, которые при растворении практически полностью диссоциируют.
У них значение степени диссоциации стремится к единице.
ü Слабые электролиты – такие, которые при растворении почти не диссоциируют. Их степень диссоциации стремится к нулю.
Из этого делаем вывод, что переносчиками электрического заряда (носителями электрического тока) в растворах электролитов являются не электроны, а положительно и отрицательно заряженные гидратированные ионы.
Температурная зависимость сопротивления электролита
При повышении температурыоблегчается процесс диссоциации, повышается подвижность ионов и сопротивление электролита падает.
Катод и анод. Катионы и анионы
А что же происходит с ионами под воздействием электрического тока?
Вернёмся к нашему прибору:
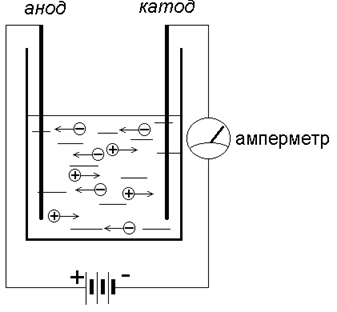
В растворе CuSO4 диссоциировал на ионы – Cu2+ и SO42-. Положительно заряженный ион Cu2+ (катион) притягивается к отрицательно заряженному электроду – катоду, где получает недостающие электроны и восстанавливается до металлической меди – простого вещества. Если извлечь катод из прибора после прохождения через раствор тока, то нетрудно заметить красно-рыжий налет – это металлическая медь.
Первый закон Фарадея
А можем ли мы узнать сколько меди выделилось? Взвешивая катод до и после опыта, можно точно определить массу осадившегося металла. Измерения показывают, что масса вещества, выделевшегося на электродах, зависит от силы тока и времени электролиза:
где K – коэффиент пропорциональности, называемый также электрохимическим эквивалентом.
Следовательно, масса выделевшегося вещества прямо пропорциональна силе тока и времени электролиза. Но ток за время (согласно формуле):
Итак, масса вещества, выделевшегося на электроде, пропорциональна заряду, или количеству электричества, прошедшему через электролит.
Этот закон был эксперементально открыт в 1843 году английским ученым Майклом Фарадеем и называется первый закон Фарадея.
Второй закон Фарадея
А что такое и от чего зависит электрохимический эквивалент? На этот вопрос тоже дал ответ Майкл Фарадей.
На основании многочисленных опытов он пришёл к выводу, что эта величина является характерной для каждого вещества. Так, например при электролизе раствора ляписа (азотнокислого серебра AgNO3) 1 кулон выделяет 1,1180 мг серебра; точно такое же количество серебра выделяется при электролизе зарядом в 1 кулон любой серебряной соли. При электролизе соли другого металла 1 кулон выделяет другое количество данного металла. Таким образом, электрохимическим эквивалентом какого-либо вещества называется масса этого вещества, выделяемая при электролизе 1кулоном протекшего через раствор электричества. Приведем его значения для некоторых веществ:
По способности проводить ток в водном растворе или расплавленном состоянии вещества делятся на две группы: электролиты и неэлектролиты.
Электролиты — вещества, водные растворы или расплавы которых проводят электрический ток. Неэлектролиты — это вещества, водные растворы или расплавы которых электрический ток не проводят.
В отличие от металлов (проводники первого рода, электрический ток проводят за счет свободных электронов), электролиты проводят электрический ток за счет свободно движущихся ионов, поэтому называются проводниками второго рода. Примеры электролитов: KCl, NH 4 NO 3 , KOH, H 2 SO 4 , CH 3 COOK, HNO 3 , H 2 O. Примеры неэлектролитов: бензол, сахароза, альдегиды, спирты, азот, кислород, водород, углеводороды.
Ионы в электролитах существуют либо изначально (ионные кристаллы: соли, щелочи), либо появляются вследствие взаимодействия полярных молекул вещества с диполями воды (рис. 11.1).
В случае ионных кристаллов роль воды в диссоциации состоит в разрушении кристалла (рис. 11.1, а ) и переводе ионов вещества в состояние подвижных гидратированных ионов. Для полярных молекул вода непосредственно участвует в образовании первоначально отсутствующих ионов.
Процесс распада (диссоциации) вещества на подвижные ионы называется электролитической диссоциацией . Основы теории электролитической диссоциации заложил С. Аррениус (1887).
В расплавах диссоциация происходит под действием температуры: при нагревании ионных кристаллов возрастает энергия колебания ионов в узлах кристаллической решетки, что в конце концов приводит к ее разрушению и образованию подвижных ионов.
Пренебрегая активной ролью воды в процессе, уравнение электролитической диссоциации записывают как распад вещества на свободные (подвижные) ионы (обычно вместо знака равно используют стрелку →):
(на самом деле в водных растворах катион H + не существует, а образуются ионы H 3 O + : H + + H 2 O = H 3 O + )
KNO 3 → K + + NO 3 −
Под действием постоянного электрического тока положительно заряженные ионы направляются к отрицательно заряженному электроду (катоду), поэтому их называют катионами ; отрицательно заряженные ионы, которые устремляются к положительно заряженному электроду (аноду), называются анионами . Благодаря такому направленному движению ионов электролиты и проводят электрический ток.
Ионы по физическим, химическим и физиологическим свойствам отличаются от нейтральных атомов, из которых они образовались. Например, ионы калия K + и хлорид-ионы Cl − не имеют цвета, запаха, не ядовиты. Атомы калия энергично взаимодействуют с водой. Вещество хлор Cl 2 — это газ желто-зеленого цвета, ядовит, сильный окислитель.
А) Вещества, растворы которых проводят электрический ток. Б) Вещества, которые распадаются на ионы. В) Вещества, которые не проводят электрический ток. Г) Ток в самих веществах.
2. Что такое электрическая диссоциация?
А) Распад ионов на электролиты. Б) Процесс распада электролита на ионы.
В) Распад любого вещества на ионы. Г) Просто ионы в веществах.
3. Неэлектролитами называют:
А)Процесс распада электролитов Б) Ток, через которые проходят вещества.
В) Вещества, растворы которых проводят электрический ток.
Г) Вещества, растворы которых НЕ проводят электрический ток.
4. К электролитам относят а) HNO2 б) SO3 в) Cl2 г) К2О
5. Какие вещества легче распадаются?
А) С ионной связью. Б) С полярной. В) С неполярной.
Г) Таких веществ не существует.
6. Электронная формула иона Li+ а) 1S2 б) 1S22S1 в) 1S22S2 г) 1S1
7. Какими концами соединяются вещества с растворителями?
А) Противоположными Б) Такими же, какими они и заряжены.
В) Отрицательными Г) Положительными.
8. Что происходит с сильными электролитами в воде?
А) Практически полностью распадаются на ионы.
Б) Абсолютно распадаются В) Не распадаются Г) Взрываются.
9. Причиной электролитической диссоциации является
а) ионизация б) гидратация в) ассоциация в) кристаллизация
10. Степень диссоциации-…
А) Отношение числа частиц, распавшихся на ионы к общему числу растворенных частиц Б) Произведение силы тока на раствор В) Сложение вещества и раствора Г) Отношение раствора на вещество.
11. Два иона образуются при диссоциации одной молекулы
а) Са(NO2)2 б) Al(NO3)3 в) NН4Br г) К2SO4
12. При растворение в воде, электролиты диссоциируются на …
А) На отрицательные и положительные ионы Б) На отрицательные В) На положительные Г) Не диссоциируются.
13. Фосфат калия диссоциирует на
А) катион калия и фосфат-анион Б)2 катиона калия и 3 фосфат – аниона
В) 3 катиона калия и фосфат-анион Г) катион калия и 4 фосфат – аниона
14. Сторонником физической теории растворения был
а) Й.Я.Берцелиус б) А.М. Бутлеров в) С. Аррениус г) Д.И.Менделеев
15. Причиной диссоциации электролита в водном растворе(воде) является …
А) Гидратация. Б) Электроотрицательность. В) Свойства вещества. Г) Ступень диссоциации.
16. Сложным анионом является а) ClO3- б) Ca2+ в) NH4+ г) S2-
17. Слово «Ион» в переводе с греческого означает
А) Нейтральный Б) Веселый В) Заряженный Г) Странствующий
А) Отрицательно заряженные ионы Б) Положительно заряженные ионы
В) Положительно и отрицательно заряженные ионы Г) Вещество
19. Анионами называются:
А) Отрицательно заряженные ионы Б) Положительно заряженные ионы
В) Положительно и отрицательно заряженные ионы Г) Вещество
20.Под действием электрического тока катионы движутся к
А) остаются на месте Б) аноду В) соединяются с водой Г) к катоду
21.Под действием электрического тока анионы движутся к
А) к катоду Б) аноду В)соединяются с водой Г)остаются на месте
22.Основания- электролиты, которые при диссоциации образуют :
А) катионы металла и анионы гидроксильных групп Б) катионы водорода и кислотного остатка В) катионы металла и кислотного остатка Г) не диссоциируют
23.Кислоты- электролиты, которые при диссоциации образуют :
А)катионы металла и анионы гидроксильных групп Б) катионы водорода и кислотного остатка В) катионы металла и кислотного остатка Г)не диссоциируют
24.Соли- электролиты, которые при диссоциации образуют :
А) катионы металла и анионы гидроксильных групп Б) катионы водорода и кислотного остатка В) катионы металла и кислотного остатка Г) не диссоциируют
25.Серная кислота диссоциирует на:
А) 2 катиона водорода и 1 сульфат-анион
Б) катион водорода и 2 сульфат- аниона
В) на 2 катиона водорода и сульфат- аниона
Г) на катион водорода и 4 сульфат- аниона
26.Гидроксид бария диссоциирует на
А) 1 катион бария и 1 гидроксид – анион
Б)1 катион бария и 2 гидроксид-аниона
В)2 катиона бария и 1 гидроксид- анион
Г) 2 катиона бария и 2 гидроксид- аниона
27. Фосфорная кислота диссоциирует на: А) 2 катиона водорода и 1 –анион Б) катион водорода и 2 фосфат – аниона В) на 2 катиона водорода и фосфат – аниона Г) на 3 катиона водорода и фосфат- аниона
28. Отношение числа частиц, распавшихся на ионы, к общему числу растворенных частиц а) степень гидратации б) степень диссоциации в) степень ионизации г) растворимость вещества