
Первый закон
Если пропускать через раствор медного купороса электрический ток в течение определённого количества времени, то на катоде выделяется небольшое количество меди. Однако если пустить ток большей силы, за такое же количество времени на катоде образуется большее количество меди. При увеличении времени и одинаковой силе тока также увеличивается количество меди.

Рис. 1. Майкл Фарадей.
Фарадей установил взаимосвязь массы вещества, силы тока и времени. Математически эта взаимосвязь выражается следующим образом:
- m – масса вещества;
- k – электрохимический эквивалент;
- I – сила тока;
- t – время.
Электрохимический эквивалент – это масса вещества, образованная при прохождении через электролит тока в 1 А за одну секунду. Выражается как соотношение массы вещества к количеству электричества или г/Кл.
Произведение силы тока и времени выражает количество электричества: q = It. Это электрический заряд, измеряемый в кулонах (один ампер к одной секунде). Электрический заряд отражает способность тела быть источником электромагнитного поля и принимать участие в электромагнитном взаимодействии.
Соответственно, уравнение Фарадея приобретает вид:

Рис. 2. Первый закон Фарадея.
Первый закон электролиза Фарадея: масса вещества, выделившегося при электролизе, прямо пропорциональна количеству электрического тока, пропущенного через электролит.
Второй закон
Фарадей, пропуская электрический ток одинаковой силы через различные электролиты, заметил, что массы веществ на электродах неодинаковы. Взвесив выделившиеся вещества, Фарадей сделал вывод, что вес зависит от химической природы вещества. Например, на каждый грамм выделенного водорода приходилось 107,9 г серебра, 31,8 г меди, 29,35 г никеля.
На основе полученных данных Фарадей вывел второй закон электролиза: для определённого количества электричества масса химического элемента, образовавшегося на электроде, прямо пропорциональна эквивалентной массе элемента. Она равна массе одного эквивалента – количеству вещества, реагирующему или замещающему 1 моль атомов водорода в химических реакциях:
- μ – молярная масса вещества;
- z – число электронов на один ион (валентное число ионов).
Для выделения одного моля эквивалента затрачивается одинаковое количество электричества – 96485 Кл/моль. Это число называется числом Фарадея и обозначается буквой F.
Согласно второму закону, электрохимический эквивалент прямо пропорционален эквивалентной массе вещества:

Рис. 3. Второй закон Фарадея.
Два закона Фарадея можно привести к общей формуле: m = (q / F) ∙ (μ/z).
Что мы узнали?
Фарадей, проводя реакцию электролиза разных веществ, вывел два закона. Согласно первому закону, масса вещества, осевшего на электрод, прямо пропорциональная количеству электричества, пропущенного через электролит: m = kq. Второй закон отражает взаимосвязь электрохимического эквивалента и эквивалентной массы вещества: k = (1/F) μeq. Электрохимический эквивалент – количество выделившегося вещества при прохождении единицы электричества. Эквивалентная масса – количество вещества, реагирующее с 1 молем водорода.
«Физика – 10 класс»
Каковы носители электрического тока в вакууме?
Каков характер их движения?
Жидкости, как и твёрдые тела, могут быть диэлектриками, проводниками и полупроводниками. К диэлектрикам относится дистиллированная вода, к проводникам — растворы и расплавы электролитов: кислот, щелочей и солей. Жидкими полупроводниками являются расплавленный селен, расплавы сульфидов и др.
Электролитическая диссоциация.
При растворении электролитов под влиянием электрического поля полярных молекул воды происходит распад молекул электролитов на ионы.
Распад молекул на ионы под влиянием электрического поля полярных молекул воды называется электролитической диссоциацией.
Степень диссоциации — доля в растворённом веществе молекул, распавшихся на ионы.
Степень диссоциации зависит от температуры, концентрации раствора и электрических свойств растворителя.
С увеличением температуры степень диссоциации возрастает и, следовательно, увеличивается концентрация положительно и отрицательно заряженных ионов.
Ионы разных знаков при встрече могут снова объединиться в нейтральные молекулы.
При неизменных условиях в растворе устанавливается динамическое равновесие, при котором число молекул, распадающихся за секунду на ионы, равно числу пар ионов, которые за то же время вновь объединяются в нейтральные молекулы.
Ионная проводимость.
Носителями заряда в водных растворах или расплавах электролитов являются положительно и отрицательно заряженные ионы.
Если сосуд с раствором электролита включить в электрическую цепь, то отрицательные ионы начнут двигаться к положительному электроду — аноду, а положительные — к отрицательному — катоду. В результате по цепи пойдёт электрический ток.
Проводимость водных растворов или расплавов электролитов, которая осуществляется ионами, называют ионной проводимостью.
Жидкости могут обладать и электронной проводимостью. Такой проводимостью обладают, например, жидкие металлы.
Электролиз. При ионной проводимости прохождение тока связано с переносом вещества. На электродах происходит выделение веществ, входящих в состав электролитов. На аноде отрицательно заряженные ионы отдают свои лишние электроны (в химии это называется окислительной реакцией), а на катоде положительные ионы получают недостающие электроны (восстановительная реакция).
Жидкости могут обладать и электронной проводимостью. Такой проводимостью обладают, например, жидкие металлы.
Процесс выделения на электроде вещества, связанный с окислительновосстановительными реакциями, называют электролизом.
От чего зависит масса вещества, выделяющегося за определённое время? Очевидно, что масса m выделившегося вещества равна произведению массы m0i одного иона на число Ni ионов, достигших электрода за время Δt:
Масса иона m0i равна:

где М — молярная (или атомная) масса вещества, a NA — постоянная Авогадро, т. е. число ионов в одном моле.
Число ионов, достигших электрода, равно:

где Δq = IΔt — заряд, прошедший через электролит за время Δt; q0i — заряд иона, который определяется валентностью n атома: q0i = пе (е — элементарный заряд). При диссоциации молекул, например КВr, состоящих из одновалентных атомов (n = 1), возникают ионы К + и Вr – . Диссоциация молекул медного купороса ведёт к появлению двухзарядных ионов Си 2+ и SO 2- 4 (n = 2). Подставляя в формулу (16.3) выражения (16.4) и (16.5) и учитывая, что Δq = IΔt, a q0i = nе, получаем

Закон Фарадея.
Обозначим через k коэффициент пропорциональности между массой m вещества и зарядом Δq = IΔt, прошедшим через электролит:

где F = eNA = 9,65 • 10 4 Кл/моль — постоянная Фарадея.
Коэффициент k зависит от природы вещества (значений М и n). Согласно формуле (16.6) имеем
Закон электролиза Фарадея:
Масса вещества, выделившегося на электроде за время Δt. при прохождении электрического тока, пропорциональна силе тока и времени.
Это утверждение, полученное теоретически, впервые было установлено экспериментально Фарадеем.
Величину k в формуле (16.8) называют электрохимическим эквивалентом данного вещества и выражают в килограммах на кулон (кг/Кл).
Из формулы (16.8) видно, что коэффициент к численно равен массе вещества, выделившегося на электродах, при переносе ионами заряда, равного 1 Кл.

Электрохимический эквивалент имеет простой физический смысл. Так как M/NA = m0i и еn = q0i, то согласно формуле (16.7) k = rn0i/q0i, т. е. k — отношение массы иона к его заряду.
Измеряя величины m и Δq, можно определить электрохимические эквиваленты различных веществ.
Убедиться в справедливости закона Фарадея можно на опыте. Соберём установку, показанную на рисунке (16.25). Все три электролитические ванны заполнены одним и тем же раствором электролита, но токи, проходящие через них, различны. Обозначим силы токов через I1, I2, I3. Тогда I1 = I2 + I3. Измеряя массы m1, m2, m3 веществ, выделившихся на электродах в разных ваннах, можно убедиться, что они пропорциональны соответствующим силам токов I1, I2, I3.
Определение заряда электрона.
Формулу (16.6) для массы выделившегося на электроде вещества можно использовать для определения заряда электрона. Из этой формулы вытекает, что модуль заряда электрона равен:

Зная массу m выделившегося вещества при прохождении заряда IΔt, молярную массу М, валентность п атомов и постоянную Авогадро NA, можно найти значение модуля заряда электрона. Оно оказывается равным e = 1,6 • 10 -19 Кл.
Именно таким путём и было впервые в 1874 г. получено значение элементарного электрического заряда.
Применение электролиза. Электролиз широко применяют в технике для различных целей. Электролитическим способом покрывают поверхность одного металла тонким слоем другого (никелирование, хромирование, позолота и т. п.). Это прочное покрытие защищает поверхность от коррозии. Если обеспечить хорошее отслаивание электролитического покрытия от поверхности, на которую осаждается металл (этого достигают, например, нанося на поверхность графит), то можно получить копию с рельефной поверхности.
Процесс получения отслаиваемых покрытий — гальванопластика — был разработан русским учёным Б. С. Якоби (1801—1874), который в 1836 г. применил этот способ для изготовления полых фигур для Исаакиевского собора в Санкт-Петербурге.
Раньше в полиграфической промышленности копии с рельефной поверхности (стереотипы) получали с матриц (оттиск набора на пластичном материале), для чего осаждали на матрицы толстый слой железа или другого вещества. Это позволяло воспроизвести набор в нужном количестве экземпляров.
При помощи электролиза осуществляют очистку металлов от примесей. Так, полученную из руды неочищенную медь отливают в форме толстых листов, которые затем помещают в ванну в качестве анодов. При электролизе медь анода растворяется, примеси, содержащие ценные и редкие металлы, выпадают на дно, а на катоде оседает чистая медь.
При помощи электролиза получают алюминий из расплава бокситов. Именно этот способ получения алюминия сделал его дешёвым и наряду с железом самым распространённым в технике и быту.
С помощью электролиза получают электронные платы, служащие основой всех электронных изделий. На диэлектрик наклеивают тонкую медную пластину, на которую наносят особой краской сложную картину соединяющих проводов. Затем пластину помещают в электролит, где вытравливаются не закрытые краской участки медного слоя. После этого краска смывается, и на плате появляются детали микросхемы.
Источник: «Физика – 10 класс», 2014, учебник Мякишев, Буховцев, Сотский
Электрический ток в различных средах – Физика, учебник для 10 класса – Класс!ная физика
Электролиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплавэлектролита.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создается электродами — проводниками, соединёнными с полюсами источника электрической энергии. Анодом при электролизе называется положительный электрод, катодом — отрицательный [1] . Положительные ионы — катионы — (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательныеионы — анионы — (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
Явление электролиза широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения алюминия, водорода, а также гидроксида натрия, хлора, хлорорганических соединений [ источник не указан 1700 дней ] , диоксида марганца [2] ,пероксида водорода. Большое количество металлов извлекаются из руд и подвергаются переработке с помощью электролиза (электроэкстракция,электрорафинирование). Также, электролиз является основным процессом, благодаря которому функционирует химический источник тока.
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации). Применяется для получения многих веществ (металлов, водорода, хлора и др.), при нанесении металлических покрытий (гальваностегия), воспроизведении формы предметов (гальванопластика).
Первый закон Фарадея
Первый закон электролиза Фарадея: масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод. Под количеством электричества имеется в виду электрический заряд, измеряемый, как правило, в кулонах.
В 1832 году Фарадей установил, что масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит: 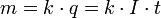 если через электролит пропускается в течение времени t постоянный ток с силой тока I. Коэффициент пропорциональности
если через электролит пропускается в течение времени t постоянный ток с силой тока I. Коэффициент пропорциональности 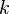 называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
Вывод закона Фарадея
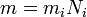 (1)
(1)
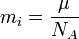 (2)
(2)
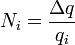 (3)
(3)
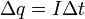 (4)
(4)
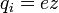 , где z — валентность атома (иона) вещества, e — заряд электрона (5)
, где z — валентность атома (иона) вещества, e — заряд электрона (5)
Подставляя (2)-(5) в (1), получим
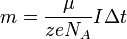
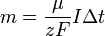
где 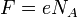 — постоянная Фарадея.
— постоянная Фарадея.
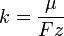
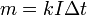
Второй закон Фарадея
Второй закон электролиза Фарадея: для данного количества электричества масса химического элемента, осаждённого на электроде, прямо пропорциональна эквивалентной массе элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество.
Электрохимические эквиваленты различных веществ относятся, как их химические эквиваленты.
Химическим эквивалентом иона называется отношение молярной массы A иона к его валентности z. Поэтому электрохимический эквивалент
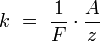
где 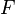 — постоянная Фарадея.
— постоянная Фарадея.
Второй закон Фарадея записывается в следующем виде:
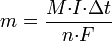
где 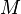 — молярная масса данного вещества, образовавшегося (однако не обязательно выделившегося — оно могло и вступить в какую-либо реакцию сразу после образования) в результате электролиза, г/моль;
— молярная масса данного вещества, образовавшегося (однако не обязательно выделившегося — оно могло и вступить в какую-либо реакцию сразу после образования) в результате электролиза, г/моль; 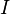 — сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), А;
— сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), А; 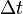 — время, в течение которого проводился электролиз, с;
— время, в течение которого проводился электролиз, с; 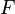 — постоянная Фарадея,Кл·моль −1 ;
— постоянная Фарадея,Кл·моль −1 ; 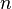 — число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона (и его противоиона), принявшего непосредственное участие в электролизе (окисленного или восстановленного). Однако это не всегда так; например, при электролизе раствора соли меди(II) может образовываться не только свободная медь, но и ионы меди(I) (при небольшой силе тока).
— число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона (и его противоиона), принявшего непосредственное участие в электролизе (окисленного или восстановленного). Однако это не всегда так; например, при электролизе раствора соли меди(II) может образовываться не только свободная медь, но и ионы меди(I) (при небольшой силе тока).
