Электрохимическая коррозия – самый распространенный вид коррозии. Электрохимическая коррозия возникает при контакте металла с окружающей электролитически проводящей средой. При этом восстановление окислительного компонента коррозионной среды протекает не одновременно с ионизацией атомов металла и от электродного потенциала металла зависят их скорости. Первопричиной электрохимической коррозии является термодинамическая неустойчивость металлов в окружающих их средах. Ржавление трубопровода, обивки днища морского суда, различных металлоконструкций в атмосфере – это, и многое другое, примеры электрохимической коррозии.
К электрохимической коррозии относятся такие виды местных разрушений, как питтинги, межкристаллитная коррозия, щелевая. Кроме того процессы электрохимической коррозии происходят в грунте, атмосфере, море.
Механизм электрохимической коррозии может протекать по двум вариантам:
1) Гомогенный механизм электрохимической коррозии:
– поверхностный слой мет. рассматривается как гомогенный и однородный;
– причиной растворения металла является термодинамическая возможность протекания катодного или же анодного актов;
– К и А участки мигрируют по поверхности во времени;
– скорость протекания электрохимической коррозии зависит от кинетического фактора (времени);
– однородную поверхность можно рассматривать как предельный случай, который может быть реализован и в жидких металлах.
2) Гетерогенный механизм электрохимической коррозии:
– у твердых металлов поверхность негомогенная, т.к. разные атомы занимают в сплаве различные положения в кристаллической решетке;
– гетерогенность наблюдается при наличии в сплаве инородных включений.
Электрохимическая коррозия имеет некоторые особенности: делится на два одновременно протекающих процесса (катодный и анодный), которые кинетически зависимы друг от друга; на некоторых участках поверхности электрохимическая коррозия может принять локальный характер; растворение основного мет. происходит именно на анодах.
Поверхность любого металла состоит из множества короткозамкнутых через сам металл микроэлектродов. Контактируя с коррозионной средой образующиеся гальванические элементы способствуют электрохимическому его разрушению.
Причины возникновения местных гальванических элементов могут быть самые разные:
1) неоднородность сплава
– неоднородность мет. фазы, обусловленная неоднородностью сплава и наличием микро- и макровключений;
– неравномерность окисных пленок на поверхности за счет наличия макро- и микропор, а также неравномерного образования вторичных продуктов коррозии;
– наличие на поверхности границ зерен кристаллов, выхода дислокации на поверхность, анизотропность кристаллов.
2) неоднородность среды
– область с ограниченным доступом окислителя будет анодом по отношению к области со свободным доступом, что ускоряет электрохимическую коррозию.
3) неоднородность физических условий
– облучение (облученный участок – анод);
– воздействие внешних токов (место входа блуждающего тока – катод, место выхода – анод);
– температура (по отношению к холодным участкам, нагретые являются анодами) и т. д.
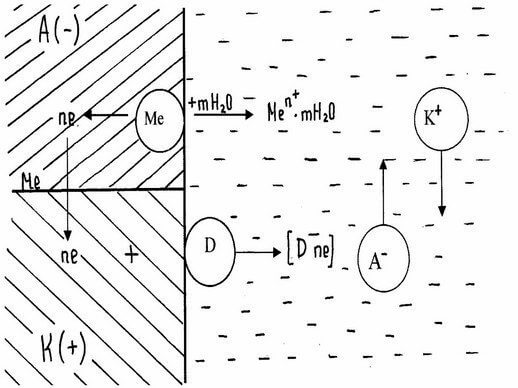
При работе гальванического элемента одновременно протекает два электродных процесса:
Анодный – ионы металла переходят в раствор
Происходит реакция окисления.
Катодный – избыточные электроны ассимилируются молекулами или атомами электролита, которые при этом восстанавливаются. На катоде проходит реакция восстановления.
O2 + 2H2O + 4e → 4OH – (кислородная деполяризация в нейтральных, щелочных средах)
O2 + 4H + + 4e → 2H2O (кислородная деполяризация в кислых средах)
2 H + + 2e → H2 (при водородной деполяризации).
Торможение анодного процесса приводит к торможению и катодного.
При соприкосновении двух электропроводящих фаз (например, мет. – среда), когда одна из них заряжена положительно, а другая отрицательно, между ними возникает разность потенциала. Это явление связано с возникновением двойного электрического слоя (ДЭС). Заряженные частицы располагаются несимметрично на границе раздела фаз.
Скачек потенциалов в процессе электрохимической коррозии может происходить из-за двух причин:
При достаточно большой энергии гидратации ионы металла могут отрываться и переходить в раствор, оставляя на поверхности эквивалентное число электронов, которые определяют ее отрицательный заряд. Отрицательно заряженная поверхность притягивает к себе катионы мет. из раствора. Так на границе раздела фаз возникает двойной электрический слой.
На поверхности металла разряжаются катионы электролита. Это приводит к тому, что поверхность мет. приобретает положительный заряд, который с анионами раствора образует двойной электрический слой.
Иногда возникает ситуация, когда поверхность не заряжена и, соответственно, отсутствует ДЭС. Потенциал, при котором это явление наблюдается называется потенциалом нулевого заряда (φN). У каждого металла потенциал нулевого заряда свой.
Величина электродных потенциалов оказывает очень большое влияние на характер коррозионного процесса.
Скачок потенциала между двух фаз не может быть измерен, но при помощи компенсационного метода можно измерить электродвижущую силу элемента (ЭДС), который состоит из электрода сравнения (его потенциал условно принят за ноль) и исследуемого электрода. В качестве электрода сравнения берется стандартный водородный электрод. ЭДС гальванического элемента (стандартный водородный электрод и исследуемый элемент) называют электродным потенциалом. Электродами сравнения могут также выступать хлорсеребряный, каломельный, насыщенный медно-сульфатный.
Международной конвенцией в Стокгольме 1953г. решено при записях электрод сравнения всегда ставить слева. При этом ЭДС рассчитывать, как разность потенциалов правого и левого электродов.
Если положительный заряд внутри системы движется слева направо – ЭДС элемента считается положительной, при этом
где F – число Фарадея. Если положительные заряды будут двигаться в противоположном направлении, то уравнение будет иметь вид:
При коррозии в электролитах самыми распространенными и значимыми являются адсорбционные (адсорбция катионов или анионов на границе раздела фаз) и электродные потенциалы (переход катионов из металла в электролит или наоборот).
Электродный потенциал, при котором металл находится в состоянии равновесия с собственными ионами называется равновесный (обратимый). Он зависит от природы металлической фазы, растворителя, температуры электролита, активности ионов мет.
Равновесный потенциал подчиняется уравнению Нернста:
где, E ο – стандартный потенциал мет.; R – молярная газовая постоянная; n – степень окисления иона мет.; Т – температура; F – число Фарадея;αMe n+ – активность ионов мет.
При установленном равновесном потенциале электрохимическая коррозия не наблюдается.
Если по электроду проходит электрический ток – равновесное состояние его нарушается. Потенциал электрода изменяется в зависимости от направления и силы тока. Изменение разности потенц., приводящее к уменьшению силы тока, принято называть поляризацией. Уменьшение поляризуемости электродов называют деполяризацией.
Скорость электрохимической коррозии тем меньше, чем больше поляризация. Поляризация характеризуется величиной перенапряжения.
Поляризация бывает трех типов:
– электрохимическая (при замедлении анодного или катодного процессов);
– концентрационная (наблюдается, когда скорость подхода деполяризатора к поверхности и отвода продуктов коррозии мала);
– фазовая (связана с образованием на поверхности новой фазы).
Электрохимическая коррозия наблюдается также при контакте двух разнородных металлов. В электролите они образуют гальванопару. Более электроотрицательный из них будет анодом. Анод в процессе будет постепенно растворяться. При этом идет замедление или даже полное прекращение электрохимической коррозии на катоде (более электроположительном). Например, при контакте в морской воде дюралюминия с никелем интенсивно растворятся будет именно дюралюминий.
Часть I
1. Коррозия – это самопроизвольное разрушение металлов и сплавов под действием окружающей среды.
2.
Типы коррозии

3.Условия протекания электрохимической коррозии:
1) Влага
2) Кислород атмосферный
4. Вред, который наносит коррозия:
а) страдает экология;
б) теряется 25% всего произведенного железа;
в) портятся металлические изделия;
г) страдает здоровье людей.
5. Заполните таблицу «Защита металлов от коррозии».

Часть II
1. Запишите уравнение реакций, протекающих на воздухе с литием, лишённым вазелиновой защиты.

2. «По крыше выложили жесть» (В. В. Маяковский). Опишите процессы, происходящие с белой жестью при нарушении оловянной защиты.

Железо ржавеет.
3. Заполните таблицу «Свойства некоторых легированных сталей и их примесей».

4. Опишите, какие способы защиты металлов от коррозии используются у вас в ванной комнате и на кухне.
Эмаль, лаки, краски.
5. Напишите синквейн о коррозии металлов.
а) Коррозия
б) Вредный, портящий
в) Разрушает, мешает, портит
г) Вредный процесс, разлагает
д) Металлы
6. Перечислите наиболее часто используемые способы защиты от коррозии изделий, изображенных на рисунках.
а) Покрытие сплавом мельхиора.
б) Эмаль
в) Легирование стали ванадием.
г) Легирование хромом
д) Лужение оловом
е) Легирование титаном
7. Приведите примеры электрохимических процессов (электрохимической коррозии), приносящих людям пользу.
1) Гальванотехника – нанесение покрытия в виде металлов и сплавов.
2) Электрофорез, электродиализ, электроосмос.
Электрохимическая коррозия — это коррозия в среде электролита с возникновением в системе электрического тока.
Электрохимическая коррозия протекает с разделением общего процесса на анодный и катодный и с локализацией их на различных участках корродирующей поверхности. Локализация анодных и катодных процессов происходит обычно на участках, различающихся по своим физическим и химическим свойствам. Это могут быть макро- и микровключения (металлические и неметаллические), неоднородность сплава, неоднородность поверхности. Кроме того, разделение корродирующей поверхности металла на катодные и анодные участки может быть вызвано неравномерным нагревом различных участков поверхности или неравномерным распределением возле корродирующей поверхности собственных ионов металла, ионов водорода, кислорода и т.д.
Коррозия металла в средах, имеющих ионную проводимость, происходит за счет анодного окисления металла:Ме + + яе – и катодного восстановления окислителя: Ох + пе
—» Red, где Me — металл; Ox, Red — окисленная и восстановленная формы имеющегося в коррозионной среде вещества. Окислителями при коррозии служат молекулы 09, С12, ионы Н + , Fe 3+ , N0“ и другие.
При изучении коррозии так же, как и в других разделах электрохимии, используют значение электродных потенциалов. При этом окружающая среда в зависимости от ее природы имеет различное значение электродного потенциала. Стандартные электродные потенциалы металлов (ряд напряжений) приведены в табл. 2.1.
Стандартные потенциалы восстановления
Уравнение электродного процесса
Стандартный потенциал при 25 °C, В
Уравнение электродного процесса
Стандартный потенциал при 25 °C, В
Возможность протекания электрохимической коррозии зависит от значения 
где AG — энергия Гиббса; п — наименьшее общее кратное числа электронов, принимающих участие в окислительно-восстановительном процессе; Дер — разность электродных потенциалов металла и окислителя.
Без большой погрешности, в соответствии с современными знаниями, возможность электрохимической коррозии можно оценить по значениям потенциалов металла и окислителя, т.е., если Фокисл > фМе, т0 ко Р _ розия возможна.
Таким образом, единственным условием, необходимым для протекания электрохимической коррозии, является возможность совместного действия анодной реакции окисления металла и катодной реакции восстановления тех или иных ионов и молекул на поверхности металла. Это условие реализуется в том случае, когда равновесный анодный потенциал более отрицателен, чем потенциал хотя бы одной из возможных катодных реакций: 
Известно, что процесс коррозии в разных средах для одного и того же металла протекает с разными скоростями и можно выделить четыре типичных случая различной среды:
1. Нейтральная среда (чистая вода — pH = 7):

2. Кислая среда (pH = 0). Так как реалиями жизни стали кислотные дожди, которые повышают кислотность грунтовых и сточных вод, окружающая среда часто представлена кислотным окружением, в котором агрессором выступает ион Н + , восстановление идет по схеме:

3. Нейтральная среда с растворенным кислородом (pH = 7). В чистой воде всегда присутствует растворенный кислород, который увеличивает агрессивность воды.

4. Кислая среда с растворенным кислородом (pH = 0):

Рассмотрим, какие металлы могут быть окислены растворенным в воде кислородом, а какие — ионами Н + .
Так как величина равновесного потенциала кислородного электрода определяется по формуле (2.11), то, когда pH = 7, эта величина равна 0,81 В. Следовательно, растворенный в Н20 или в нейтральном водном растворе 02 может окислить те металлы, потенциал которых меньше 0,81 В. Они расположены в ряду напряжений от его начала до Ag.
Величина равновесного потенциала водородного электрода в нейтральной водной среде (pH = 7) определяется по формуле (2.9):
 В. Следовательно, Н + может окислить только те металлы, потенциал которых меньше —0,42 В. Это металлы до Cd. Таким образом, вода, содержащая растворенный 02, значительно опаснее в коррозионном отношении, чем вода, не содержащая его.
В. Следовательно, Н + может окислить только те металлы, потенциал которых меньше —0,42 В. Это металлы до Cd. Таким образом, вода, содержащая растворенный 02, значительно опаснее в коррозионном отношении, чем вода, не содержащая его.

