Содержание
Электрохимическая защита – эффективный способ защиты готовых изделий от электрохимической коррозии. В некоторых случаях невозможно возобновить лакокрасочное покрытие или же защитный оберточный материал, тогда целесообразно использовать электрохимическую защиту. Покрытие подземного трубопровода или же днища морского суда очень трудоемко и дорого возобновлять, иногда просто невозможно. Электрохимическая защита надежно защищает изделие от коррозии, предупреждая разрушение подземных трубопроводов, днищ судов, различных резервуаров и т.п.
Применяется электрохимическая защита в тех случаях, когда потенциал свободной коррозии находится в области интенсивного растворения основного металла либо перепассивации. Т.е. когда идет интенсивное разрушение металлоконструкции.
Суть электрохимической защиты
К готовому металлическому изделию извне подключается постоянный ток (источник постоянного тока или протектор). Электрический ток на поверхности защищаемого изделия создает катодную поляризацию электродов микрогальванических пар. Результатом этого является то, что анодные участки на поверхности металла стают катодными. А вследствии воздействия коррозионной среды идет разрушение не металла конструкции, а анода.
В зависимости от того, в какую сторону (положительную или отрицательную) смещается потенциал металла, электрохимическую защиту подразделяют на анодную и катодную.
Катодная защита от коррозии
Катодная электрохимическая защита от коррозии применяется тогда, когда защищаемый металл не склонен к пассивации. Это один из основных видов защиты металлов от коррозии. Суть катодной защиты состоит в приложении к изделию внешнего тока от отрицательного полюса, который поляризует катодные участки коррозионных элементов, приближая значение потенциала к анодным. Положительный полюс источника тока присоединяется к аноду. При этом коррозия защищаемой конструкции почти сводится к нулю. Анод же постепенно разрушается и его необходимо периодически менять.
Существует несколько вариантов катодной защиты: поляризация от внешнего источника электрического тока; уменьшение скорости протекания катодного процесса (например, деаэрация электролита); контакт с металлом, у которого потенциал свободной коррозии в данной среде более электроотрицательный (так называемая, протекторная защита).
Поляризация от внешнего источника электрического тока используется очень часто для защиты сооружений, находящихся в почве, воде (днища судов и т.д.). Кроме того данный вид коррозионной защиты применяется для цинка, олова, алюминия и его сплавов, титана, меди и ее сплавов, свинца, а также высокохромистых, углеродистых, легированных (как низко так и высоколегированных) сталей.
Внешним источником тока служат станции катодной защиты, которые состоят из выпрямителя (преобразователь), токоподвода к защищаемому сооружению, анодных заземлителей, электрода сравнения и анодного кабеля.
Катодная защита применяется как самостоятельный, так и дополнительный вид коррозионной защиты.
Главным критерием, по которому можно судить о эффективности катодной защиты, является защитный потенциал. Защитным называется потенциал, при котором скорость коррозии металла в определенных условиях окружающей среды принимает самое низкое (на сколько это возможно) значение.
В использовании катодной защиты есть свои недостатки. Одним из них является опасность перезащиты. Перезащита наблюдается при большом смещении потенциала защищаемого объекта в отрицательную сторону. При этом выделяется. В результате – разрушение защитных покрытий, водородное охрупчивание металла, коррозионное растрескивание.
Протекторная защита (применение протектора)
Разновидностью катодной защиты является протекторная. При использовании протекторной защиты к защищаемому объекту подсоединяется металл с более электроотрицательным потенциалом. При этом идет разрушение не конструкции, а протектора. Со временем протектор корродирует и его необходимо заменять на новый.
Протекторная защита эффективна в случаях, когда между протектором и окружающей средой небольшое переходное сопротивление.
Каждый протектор имеет свой радиус защитного действия, который определяется максимально возможным расстоянием, на которое можно удалить протектор без потери защитного эффекта. Применяется протекторная защита чаще всего тогда, когда невозможно или трудно и дорого подвести к конструкции ток.
Протекторы используются для защиты сооружений в нейтральных средах (морская или речная вода, воздух, почва и др.).
Для изготовления протекторов используют такие металлы: магний, цинк, железо, алюминий. Чистые металлы не выполняют в полной мере своих защитных функций, поэтому при изготовлении протекторов их дополнительно легируют.
Железные протекторы изготавливаются из углеродистых сталей либо чистого железа.
Цинковые протекторы
Цинковые протекторы содержат около 0,001 – 0,005 % свинца, меди и железа, 0,1 – 0,5 % алюминия и 0,025 – 0,15 % кадмия. Цинковые проекторы применяют для защиты изделий от морской коррозии (в соленой воде). Если цинковый протектор эксплуатировать в слабосоленой, пресной воде либо почвах – он достаточно быстро покрывается толстым слоем оксидов и гидроксидов.
Протектор магниевый
Сплавы для изготовления магниевых протекторов легируют 2 – 5 % цинка и 5 – 7 % алюминия. Количество в сплаве меди, свинца, железа, кремния, никеля не должно превышать десятых и сотых долей процента.
Протектор магниевый используют в слабосоленых, пресных водах, почвах. Протектор применяется с средах, где цинковые и алюминиевые протекторы малоэффективны. Важным аспектом является то, что протекторы из магния должны эксплуатироваться в среде с рН 9,5 – 10,5. Это объясняется высокой скоростью растворения магния и образованием на его поверхности труднорастворимых соединений.
Магниевый протектор опасен, т.к. является причиной водородного охрупчивания и коррозионного растрескивания конструкций.
Алюминиевые протекторы
Алюминиевые протекторы содержат добавки, которые предотвращают образование окислов алюминия. В такие протекторы вводят до 8 % цинка, до 5 % магния и десятые-сотые доли кремния, кадмия, индия, таллия. Алюминиевые протекторы эксплуатируются в прибрежном шельфе и проточной морской воде.
Анодная защита от коррозии
Анодную электрохимическую защиту применяют для конструкций, изготовленных из титана, низколегированных нержавеющих, углеродистых сталей, железистых высоколегированных сплавов, разнородных пассивирующихся металлов. Анодная защита применяется в хорошо электропроводных коррозионных средах.
При анодной защите потенциал защищаемого металла смещается в более положительную сторону до достижения пассивного устойчивого состояния системы. Достоинствами анодной электрохимической защиты является не только очень значительное замедление скорости коррозии, но и тот факт, что в производимый продукт и среду не попадают продукты коррозии.
Анодную защиту можно реализовать несколькими способами: сместив потенциал в положительную сторону при помощи источника внешнего электрического тока или введением в коррозионную среду окислителей (или элементов в сплав), которые повышают эффективность катодного процесса на поверхности металла.
Анодная защита с применением окислителей по защитному механизму схожа с анодной поляризацией.
Если использовать пассивирующие ингибиторы с окисляющими свойствами, то защищаемая поверхность переходит в пассивное состояние под действием возникшего тока. К ним относятся бихроматы, нитраты и др. Но они достаточно сильно загрязняют окружающую технологическую среду.
При введении в сплав добавок (в основном легирование благородным металлом) реакция восстановления деполяризаторов, протекающая на катоде, проходит с меньшим перенапряжением, чем на защищаемом металле.
Если через защищаемую конструкцию пропустить электрический ток, происходит смещение потенциала в положительную сторону.
Установка для анодной электрохимической защиты от коррозии состоит из источника внешнего тока, электрода сравнения, катода и самого защищаемого объекта.
Для того, чтоб узнать, возможно ли для определенного объекта применить анодную электрохимическую защиту, снимают анодные поляризационные кривые, при помощи которых можно определить потенциал коррозии исследуемой конструкции в определенной коррозионной среде, область устойчивой пассивности и плотность тока в этой области.
Для изготовления катодов используются металлы малорастворимые, такие, как высоколегированные нержавеющие стали, тантал, никель, свинец, платина.
Чтобы анодная электрохимическая защита в определенной среде была эффективна, необходимо использовать легкопассивируемые металлы и сплавы, электрод сравнения и катод должны все время находится в растворе, качественно выполнены соединительные элементы.
Для каждого случая анодной защиты схема расположения катодов проектируется индивидуально.
Для того, чтоб анодная защита была эффективной для определенного объекта, необходимо, чтоб он отвечал некоторым требованием:
– все сварные швы должны быть выполнены качественно;
– в технологической среде материал, из которого изготовлен защищаемый объект, должен переходить в пассивное состояние;
– количество воздушных карманов и щелей должно быть минимальным;
– на конструкции не должно присутствовать заклепочных соединений;
– в защищаемом устройстве электрод сравнения и катод должны всегда находиться в растворе.
Для реализации анодной защиты в химической промышленности часто используют теплообменники и установки, имеющие цилиндрическую форму.
Электрохимическая анодная защита нержавеющих сталей применима для производственных хранилищ серной кислоты, растворов на основе аммиака, минеральных удобрений, а также всевозможных сборников, цистерн, мерников.
Анодная защита может также применяться для предотвращения коррозионного разрушения ванн химического никелирования, теплообменных установок в производстве искусственного волокна и серной кислоты.
Зная причину химической и электрохимической коррозии металлов, нетрудно выявить основные методы защиты. Так как причиной электрохимической коррозии является возникновение и работа гальванического элемента, то любое нарушение его функционирования будет предотвращать коррозию.
Все методы защиты условно делятся на следующие группы:
· защитные покрытия (металлические, неметаллические);
· электрохимическая защита (протекторная, катодная);
· изменение свойств коррозионной среды;
· рациональное конструирование изделий.
Выбор способа защиты определяется его эффективностью, а также экономической целесообразностью.
Легирование металлов.Легирование металлов – эффективный (хотя и дорогой) метод повышения коррозионной стойкости металлов. При легировании в состав сплава вводят компоненты, вызывающие пассивацию металла, т.е. образование на его поверхности защитных плёнок из оксидов легирующих добавок. В качестве таких компонентов применяют хром, никель, вольфрам и т.д.
Защитные покрытия. Слои, искусственно создаваемые на поверхности металлов для предохранения их от коррозии, называются защитными покрытиями. Защитные слои подразделяются на металлические и неметаллические.
Наиболее распространены неметаллические защитные покрытия – эмали, лаки, краски, пластмассы, различные смолы, полимеры. Защитное действие этих покрытий сводится в основном к изоляции металлов от окружающей среды. Достоинство этого способа защиты – простота технологии их нанесения. Недостаток – легко разрушаются из-за хрупкости и растрескивания при тепловых и механических ударах; эти покрытия защищают до тех пор, пока сохраняется их целостность.
Ряд покрытий, получаемых химической обработкой металла, включают защитные покрытия, образующиеся непосредственно на поверхности металла. Образование на поверхности металлических изделий защитных оксидных плёнок в технике называют оксидированием. Некоторые процессы имеют специальное название. Так, процесс нанесения на сталь оксидных плёнок иногда называют воронением, а электрохимическое оксидирование алюминия – анодированием. Оксидные покрытия на стали можно получить при высокой температуре окислением на воздухе или погружением в горячие концентрационные растворы щелочей, содержащих персульфаты, нитраты или хлораты металлов. В сухом воздухе оксидные плёнки достаточно стойки, а во влажном воздухе, воде защитные свойства их крайне невысоки.
Фосфатные покрытия, химически создаваемые на поверхности металлов, сами по себе не обеспечивают достаточной защиты от коррозии. Их используют в основном в качестве подложки под краску, что повышает сцепление лакокрасочного покрытия со сталью и уменьшает коррозию в местах царапин.
Металлические покрытия получают путем осаждения на защищаемой детали тонкого слоя другого металла, более стойкого в условиях эксплуатации, чем защищаемый металл. Материалами для металлических защитных покрытий могут быть как чистые металлы (цинк, кадмий, алюминий, никель, медь, хром, серебро и др.), так и их сплавы (бронза, латунь и др.). По характеру поведения металлических покрытий при коррозии их можно разделить на катодные и анодные.
К катодным покрытиям относятся покрытия из металлов, потенциалы которых в данной среде имеют большие значения, чем потенциал основного металла. В качестве примеров катодных покрытий на стали можно привести Cu, Ni, Ag, Sn.
Рассмотрим пример катодного покрытия. Белая жесть – железо, покрытое слоем олова (Sn), находится во влажном воздухе (O2 + H2O). При повреждении покрытия (или наличии пор) возникает коррозионный элемент, в котором защищаемый материал (Fe) служит анодом и растворятся, а материал покрытия (Sn) – катодом, т.к. 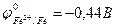
 A: Fe – 2e – = Fe 2+ 2
A: Fe – 2e – = Fe 2+ 2
K: O2 + 2H2O + 4 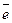 = 4OH – 1
= 4OH – 1
2Fe + O2 + 2H2O = 2Fe(OH)2  .
.
Следовательно, катодные покрытия могут защищать металл от коррозии лишь при отсутствии пор и повреждений покрытия.
Анодные покрытия имеют более отрицательный потенциал, чем потенциал основного металла. Примером анодного покрытия может служить цинк на стали:  ;
; 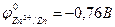 . В этом случае при нарушении целостности покрытия или возникновении пор в среде, имеющей ионную проводимость, основной металл (Fe) будет катодом возникающего коррозионного элемента и не будет корродировать, а разрушению подвергнется цинк:
. В этом случае при нарушении целостности покрытия или возникновении пор в среде, имеющей ионную проводимость, основной металл (Fe) будет катодом возникающего коррозионного элемента и не будет корродировать, а разрушению подвергнется цинк:
A: Zn – 2e – = Zn 2+ окисление
K: O2 + 2H2O + 4 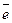 = 4OH – восстановление
= 4OH – восстановление
Цинк будет защищать основной металл пока весь не растворится . Таким образом, анодные покрытия более эффективны, т.к. защищают основные металлические конструкции и при нарушении целостности покрытия.
Потенциалы металлов зависят от состава растворов, поэтому при изменении состава раствора может меняться и характер покрытия. Так, покрытие стали оловом в растворе H2SO4 – катодное, а в растворе органических кислот – анодное.
Для получения металлических защитных покрытий применяются различные способы: электрохимический (электролиз – нанесение гальванических покрытий), погружение в расплавленный металл, металлизация (распыление расплавленного металла с помощью струи сжатого воздуха), термодиффузионный (путём диффузии металла в металл при повышенной температуре), химический (восстановление соединений металла с помощью водорода, гидразина и других восстановителей).
Электрохимическая защита.Электрохимическая защита осуществляется присоединением к защищаемой конструкции металла с меньшим значением электродного потенциала – протектора (протекторная защита) или катодной поляризацией за счёт извне приложенного тока (катодная защита).
Так, если к стальной конструкции присоединить кусок более активного металла, например магния ( 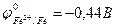 ;
; 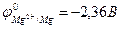 ), то в условиях появления электролита (например, конденсация влаги) защищаемая стальная конструкция будет выполнять функцию катода, а магний (протектор) – функцию анода (протекторная защита).
), то в условиях появления электролита (например, конденсация влаги) защищаемая стальная конструкция будет выполнять функцию катода, а магний (протектор) – функцию анода (протекторная защита).
 Сущность электрохимической катодной защиты заключается в том, что защищаемое изделие подключается к отрицательному полюсу внешнего источника постоянного тока, поэтому оно становится катодом, а анодом служит вспомогательный, обычно стальной электрод. В этом случает в среде электролита будет протекать электролиз. Рассмотрим пример электрохимической катодной защиты подземного трубопровода во влажной почве (рис. 10.10).
Сущность электрохимической катодной защиты заключается в том, что защищаемое изделие подключается к отрицательному полюсу внешнего источника постоянного тока, поэтому оно становится катодом, а анодом служит вспомогательный, обычно стальной электрод. В этом случает в среде электролита будет протекать электролиз. Рассмотрим пример электрохимической катодной защиты подземного трубопровода во влажной почве (рис. 10.10).
На электродах будут протекать процессы:
A: Fe – 2e – = Fe 2+
K: 2H2O + 2e = Н2 + 2OH 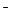
Fe + 2H2O = Fe 2+ + H2 + 2OH 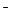 = Fe(OH)2¯ + H2.
= Fe(OH)2¯ + H2.
Вспомогательный электрод (анод) растворяется, на защищаемом трубопроводе (катоде) выделяется водород.
Катодную защиту используют для защиты от коррозии подземных и морских трубопроводов, кабелей, водных резервуаров, подводных лодок, оборудования химических заводов.
Изменение свойств коррозионной среды. Здесь применяется специальная обработка электролита или среды, в которой находится защищаемая конструкция. Вода, поступающая в котельные установки, подвергается деаэрации – удалению растворённого воздуха. Введение в электролит ингибиторов, их адсорбция на защищаемой детали резко замедляет процесс коррозии.
В последние годы широко применяют летучие парофазные игибиторы. Их используют для защиты машин, аппаратов и других металлических изделий во время их эксплуатации в воздушной атмосфере, при перевозке и хранении. Летучие ингибиторы вводятся в контейнеры, в упаковочные материалы или помещаются в непосредственной близости от рабочего агрегата. Благодаря достаточно высокому давлению паров летучие ингибиторы достигают границы раздела металл – воздух и растворяются в плёнке влаги, покрывающей металл. Далее они адсорбируются на поверхности металла.
Рациональное конструирование изделий. Рациональное конструирование изделий должно исключать наличие или сокращать число и размеры особо опасных с точки зрения коррозии участков в изделиях или конструкциях (сварных швов, узких щелей, контактов разнородных по электродным потенциалам металлов и др.), а также предусматривать специальную защиту металла этих участков от коррозии.
Контакт с металлами и неметаллами имеет большое значение для оценки опасности коррозии. В частности, при конструировании следует учитывать опасность контактной коррозии, в связи с чем нельзя без соответствующей изоляции соприкасающихся поверхностей сочетать в конструкции металлы, существенно отличающиеся по величине потенциала. Важно учитывать использование в конструкции различных неметаллических материалов, в том числе теплоизоляционных, электроизоляционных и др. Известно, что некоторые из этих материалов, например войлок, асбест, древесина, могут впитывать и удерживать влагу и, таким образом, быть очагами усиленной коррозии.
Скопление влаги в различных элементах конструкции способствует развитию коррозии. Поэтому при создании различных конструкций предусматривают возможность проветривания полостей, наличие дренажных отверстий и др. Исключительно опасно в коррозионном отношении наличие щелей и зазоров. На изделии не должно быть различных углублений, канавок и пазов, в которых может скапливаться влага. Элементы конструкции должны быть по возможности обтекаемыми; это облегчает испарение влаги.
Дата добавления: 2015-08-08 ; просмотров: 789 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Коррозия – это самопроизвольно протекающий процесс разрушения металлов в результате химического или электрохимического взаимодействия их с окружающей средой.
Электрохимическая коррозия – наиболее распространенный вид коррозии металлов, это разрушение металла в среде электролита с возникновением внутри системы электрического тока. Примером коррозионных процессов электрохимического характера является разрушение деталей машин и различных металлических конструкций в почвенных, грунтовых, речных и морских водах, во влажной атмосфере, в технических растворах, под действием смазочно-охлаждающих жидкостей, применяемых при механической обработке металлов и т.д.
Причиной электрохимической коррозии является образование на поверхности металла большого количества микрогальванических пар, которые возникают по следующим причинам:
1. Наличие примесей металлов или других веществ, отличающихся по активности от основного металла.
2. Структурная неоднородность поверхности металла, что определяет наличие участков с разной активностью.
3. Неравномерность распределения деформаций в металле после термической и механической обработки и др.
При электрохимической коррозии на поверхности металла одновременно протекают два процесса:
– анодный – окисление металла: Ме – n? = Me n+
– катодный – восстановление ионов водорода в кислой среде:
2H + + 2e = H2 или молекул кислорода, растворенного в воде, в случае атмосферной коррозии:
Ионы или молекулы, которые восстанавливаются на катоде, называются деполяризаторами. При атмосферной коррозии – коррозии во влажном воздухе при комнатной температуре – деполяризатором является кислород.
Пример 20. Как происходит коррозия цинка, находящегося в контакте с кадмием в нейтральном и кислом растворах? Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
Решение. При таком контакте возникает коррозионный гальванический микроэлемент. Цинк имеет более отрицательный потенциал (-0,763 В), чем кадмий (-0,403) (табл. 12.1), поэтому он является анодом, а кадмий – катодом.
Анодный процесс: Zn – 2? = Zn 2+ .
Катодный процесс: в кислой среде: 2H + + 2? = H2 ;
в нейтральной среде: 2H2O + O2 + 4? = 4OH – .
Так как ионы Zn 2+ с гидроксильной группой образуют нерастворимый гидроксид, то продуктом коррозии в нейтральной среде будет Zn(OH)2.
Скорость коррозии тем больше, чем сильнее различаются электродные потенциалы металлов, т.е. чем дальше они расположены друг от друга в ряду напряжений. Кроме того, скорость коррозии повышается при увеличении концентрации электролита и повышении температуры.
Защита от коррозии.
Все методы защиты условно делятся на следующие группы:
1. Легирование металлов. Это эффективный, хотя и дорогой метод повышения коррозионной стойкости металлов. При легировании в состав сплава вводят компоненты, вызывающие пассивность металла вследствие образования на их поверхностях прочных оксидных пленок. В качестве таких компонентов применяют хром, никель, вольфрам и др.);
2. Защитные покрытия (металлические, неметаллические). Металлические покрытия подразделяются на анодные и катодные. При анодном покрытии металл покрывается более активным металлом, расположенным в ряду напряжения левее, например железо – цинком, и вэтом случае при коррозии идет окисление цинка. При катодном покрытии металл покрывается менее активным металлом, например железо – оловом, и в этом случае при коррозии тдет окисление железа;
3. Электрохимическая защита (этот метод основан на торможении анодных или катодных реакций коррозионного процесса. Защита осуществляется присоединением к защищаемой конструкции металла с более отрицательным значением электродного потенциала – протектора, а также катодной или анодной поляризацией за счет тока от внешнего источника);
4. Изменение свойств коррозионной среды. Для снижения агрессивности среды уменьшают концентрацию компонентов, опасных в коррозионном отношении, например снижают концентрацию Н + – ионов – подщелачивание, удаляют кислород и др.
Пример 21. Какие процессы протекают при коррозии оцинкованного и луженого железа?
а) в кислой среде;
Решение. 1. Оцинкованное железо получают, покрывая железо тонким слоем цинка. При таком контакте возникает гальванический элемент. Цинк имеет более отрицательный потенциал (-0,763 В), чем железо (-0,44 В) (табл. 7.1), поэтому он является анодом, а железо – катодом. а) Схема ГЭ записывается в кислой среде:
Анодный процесс: Zn – 2? = Zn 2+ ;
катодный процесс: 2H + + 2? = H2 .
Следовательно, цинк в этом случае корродирует вместо железа. Подобная защита металла, при которой он играет роль катода в процессе электрохимической коррозии, называется катодной защитой, а цинк в этом случае является анодным покрытием.
б) Для коррозии на воздухе схема ГЭ: (-) Zn ½ H2O, O2 ½ Fe (+).
Анодный процесс: Zn – 2? = Zn 2+ ;
катодный процесс: 2H2O + O2 + 4? = 4OH – .
Цинк защищает железо от коррозии даже после нарушения целостности покрытия.
2. Так называемую «белую жесть» получают, покрывая тонким слоем олова листовое железо. Сравнение электродных потенциалов железа (-0,44 В) и олова (-0,13 В) показывает, что железо окисляется легче олова, поэтому железо в этой паре играет анода.
a) В кислой среде: (-) Fe ½ HCl ½ Sn (+).
Анодный процесс: Fe – 2?= Fe 2+ ;
катодный процесс: 2H + + 2? = H2 .
б) Во влажной атмосфере: (-) Fe ½ H2O, O2 ½ Sn (+).
Анодный процесс: Fe – 2?= Fe 2+ ;
катодный процесс: 2H2O + O2 + 4? = 4OH – .
Суммарный процесс: 2Fe + 2H2O + O2 = 2Fe 2+ + 4OH – .
Олово защищает железо лишь до тех пор, пока защитный слой остается неповрежденным. Стоит только его повредить, как на железо начинают воздействовать воздух и влага. Олово даже ускоряет коррозию железа, потому что служит катодом в электрохимическом процессе коррозии. Подобная защита металла, при которой он играет роль анода в процессе электрохимической коррозии, называется анодной защитой, а олово в этом случае является катодным покрытием.
Пример 22. Как будет протекать процесс коррозии в том случае, если железную водосточную трубу прибить к дому алюминиевыми гвоздями?
Решение. Сравнение электродных потенциалов железа (-0,44 В) и алюминия (-1,7 В) показывает, что алюминий этой паре является анодом, а железо – катодом. Схема ГЭ:
Таким образом, вблизи алюминиевого гвоздя труба будет защищена от коррозии. Однако алюминиевый гвоздь должен в этих условиях быстро корродировать, и в конце концов труба упадет. Продуктом коррозии будет белый порошок гидроксида алюминия.
Анодный процесс: Al – 3? = Al 3+ , х4
катодный процесс: 2H2O + O2 + 4? = 4OH – . х3
Суммарный процесс: 4Al + 6H2O + 3O2 = 4Fe 2+ + 12OH – .
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Для студента самое главное не сдать экзамен, а вовремя вспомнить про него. 10092 –  | 7528 –
| 7528 –  или читать все.
или читать все.
91.146.8.87 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
